리메드, 통증의료기기 'COMPACT-II' 美 FDA 승인…'세계 최대 시장' 본격 선점
"소형이지만 강력한 성능과 다양한 옵션 갖춰 차별화된 성장 모멘텀 만들 것"
박기훈 기자
| pkh@newsprime.co.kr |
2025.09.18 10:50:44
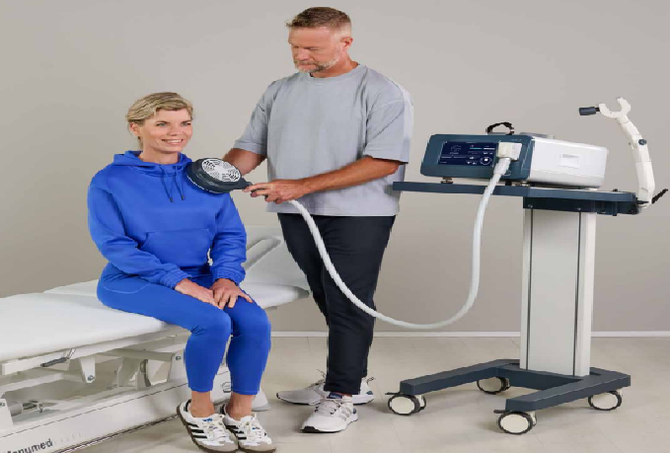
'COMPACT-II' 시연 이미지. ⓒ 리메드
[프라임경제] 글로벌 전자약 전문기업 리메드(302550)는 자사가 개발·제조해 네덜란드의 엔라프(Enraf)에 공급하고 있는 통증의료기기 'COMPACT-II'가 최근 미국 식품의약국(FDA) 510(k) 승인을 획득했다고 18일 밝혔다.
리메드 관계자는 "미국 통증시장 진출을 노리고 있는 'COMPACT-II'가 세계적으로 통과하기 어려운 규제로 꼽히는 FDA 인증을 약 5개월 만에 확보했다"고 설명했다.
리메드는 2021년 'Talent-Pro' 제품으로 FDA 승인을 받은 경험이 있다. 리메드의 제품을 엔라프가 FDA 승인을 받은 것은 비침습적 자기장 치료 기술의 우수성과 해외 시장 확장 가능성을 다시 한 번 입증한 것으로 풀이된다.
'COMPACT-II'는 병·의원 내 협소한 공간 환경을 고려해 소형화했음에도 강력한 치료 효과를 제공하는 차세대 통증·재활 장비다. 기본 탑재된 표준 트랜스듀서(Transducer)와 더불어 옵션으로 요실금 및 요·슬관절(Hip & Knee 등) 치료용 H-Activator 트랜스듀서를 장착할 수 있어 임상 현장에서 다양한 치료 목적에 활용할 수 있다.
이를 통해 근골격계 통증 완화, 관절 기능 회복, 산부인과, 스포츠 재활 등 폭넓은 분야에서 탁월한 치료 효과를 기대할 수 있다.
리메드는 독일을 대표하는 재활 전문기업 짐머 메디신 시스템(Zimmer Medizin Systeme, 이하 짐머)와의 긴밀한 파트너십을 기반으로, 짐머 그룹 산하 자회사인 엔라프에 'COMPACT-II'를 공급하고 있다.
엔라프는 1925년 설립돼 100년 가까운 역사를 지닌 글로벌 재활·물리치료 전문기업으로, 현재 전 세계 100여 개국 이상에 걸친 네트워크를 보유하고 있다. 이번 FDA 승인을 계기로 리메드는 짐머·엔라프와의 협력 관계를 한층 강화하는 동시에 본격적인 판매 확대에 나선다.
초도 물량 60대가 올해 9월 내 선적될 예정이며, 이미 연간 약 300대 이상 규모의 공급 협의가 진행되고 있어 향후 판매 확대가 가시화되고 있다. 이는 리메드의 기술력이 유럽을 넘어 북미 시장까지 진출 영역을 넓히며 글로벌 통증·재활 시장에서 입지를 강화하는 중요한 교두보가 될 전망이다.
리메드 관계자는 "'COMPACT-II'의 FDA 510(k) 승인은 리메드 기술력과 품질 경쟁력이 글로벌에서 공식적으로 검증받았다는 의미 있는 성과"라고 강조했다.
이어 "특히 소형이지만 강력한 성능과 다양한 옵션을 갖춰 미국 카이로프랙틱 및 만성 통증 시장에서 차별화된 성장 모멘텀을 만들 것"이라며 "세계적으로 검증된 짐머 그룹 계열사 엔라프와의 긴밀한 파트너십을 통해 유럽뿐만 아니라 미국 시장에서도 브랜드 가치를 높이고 매출 성장을 가속화하겠다"고 전했다.
ⓒ 프라임경제(http://www.newsprime.co.kr) 무단전재 및 재배포금지
























![[포토]](https://www.newsprime.co.kr//data/cache/public/photos/cdn/20260207/art_724391_1770945420_245x140.jpg)




