박셀바이오, 간암 치료제 임상2a상서 '질병 통제율 100%' 확인
Vax-NK/HCC와 HAIC 병합요법 예비연구결과 발표 "효과 재차 입증"
박기훈 기자
| pkh@newsprime.co.kr |
2022.09.01 08:52:40

ⓒ 박셀바이오
[프라임경제] 박셀바이오(323990)의 진행성 간암 치료제 Vax-NK/HCC와 HAIC(간동맥 내 항암주입요법) 병합요법에 대한 임상2a상 예비연구결과가 대한종양내과학회 국제학술행사(KSMO 2022) 포스터를 통해 1일 공개됐다.
이번 임상2a상 연구는 임상 1상 연구보다 공고요법 개념이 추가돼 Vax-NK/HCC가 4주 간격으로 2주기(1주기 당 5회, 총 10회)가 투여됐다.
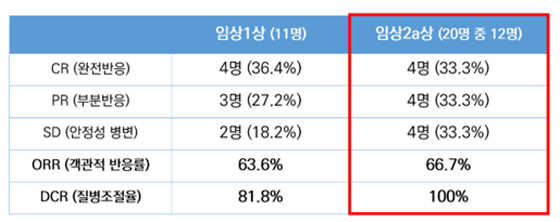
박셀바이오 관계자는 "객관적 반응률(ORR, Objective Response Rate) 66.7%, 질병 조절율(DCR, Disease Control Rate) 100% 등의 고무적인 결과를 발표하며 항암면역치료 개발 전문 회사로서 그 기술력을 다시 한 번 입증했다"고 설명했다.
Vax-NK/HCC는 박셀바이오에서 임상연구를 진행 중인 자가유래 방식의 항암면역세포치료제다. 간암 중에서도 예후가 좋지 않은 진행성 간암을 적응증으로 총 20명 환자 대상 전국 5곳의 대학병원에서 임상2a상 연구를 진행 중이다.
박셀바이오의 Vax-NK/HCC와 HAIC 병합요법은 앞서 임상1상 연구 결과로 주목받은 바 있다. 총 11명의 환자를 대상으로 한 해당 연구는 완전반응(CR, Complete Response) 4명, 부분반응(PR, Partial Response) 3명으로 63.6%에 달하는 객관적 반응률을 보였다.
더 이상 암이 진행되지 않는 안정성 병변(SD, Stable Disease 2명까지 포함하면 총 81.8%라는 높은 질병 조절율을 보였다.
Vax-NK/HCC와 HAIC 병합요법에 대한 임상2a상 예비연구결과 ⓒ 박셀바이오
박셀바이오 관계자는 "임상1상과 2a상 연구에 등록된 환자들은 진행성 간암 환자 중에서도 기존 치료제로 치료가 어려운 환자였다"며 "또한 일반적으로 소규모 인원으로 진행되는 초반 임상연구에서는 다음 단계의 임상이 진행될수록 통계적인 치료 효율이 점점 낮아지는 양상을 보인다"고 말했다.
이어 "하지만 동사는 이런 어려운 상황 속에서도 임상1상 연구 이상의 결과를 공개했다. 이는 항암면역세포치료제 전문 개발 기업으로서의 뛰어난 기술력을 입증한 셈"이라고 강조했다.
이번 예비연구결과에서는 총 12명 중 4명에서 완전반응이 관찰됐다. 부분반응과 안정성 병변 역시 각각 4명씩 관찰됐고, 초기 관찰 기간동안 암이 계속 진행된 경우(early progression, PD)는 없었다.
박셀바이오 관계자는 "아직 임상2a상 연구가 완전히 종료된 것은 아니다"라면서도 "20명의 환자 중 12명의 환자에 대한 데이터인 것을 감안해도 동사의 이번 발표는 임상1상 연구에 이어 66.7%의 객관적 반응률과 100%의 DCR을 관찰하며 그 가치를 증명했다"고 밝혔다.
이어 "안전성 평가에서 임상2a상 12명의 환자들 중 일부에서 3등급 이상의 이상반응을 보였지만 이는 연구자들이 HAIC요법과 연관된 이상반응으로 판정했으며, Vax-NK/HCC주입에 따른 중대한 부작용은 없었다"며 "이번 예비연구결과를 통해 Vax-NK/HCC와 HAIC 병합요법의 효과를 다시 한 번 입증하게 되어 기쁘다"고 덧붙였다.
이번 예비연구결과가 담긴 포스터는 내일까지 개최되는 대한종양내과학회 국제학술대회(KSMO 2022)온라인 홈페이지에서 확인할 수 있다.
금일 개최된 대한조혈모세포이식학회 국제학술대회(ICBMT 2022)에서는 오는 2일 이제중 교수가 예비연구결과와 새로운 파이프라인 등을 포함하여 암에 대한 혁신적인 세포면역치료의 임상 적용에 대해 발표할 예정이다.
한편 박셀바이오는 최근 시장 경쟁력 강화를 위해 파이프라인을 재정비했으며, 새로운 다발골수종 치료제 파이프라인인 CAR-MIL 개발 계획 등을 발표했다.
ⓒ 프라임경제(http://www.newsprime.co.kr) 무단전재 및 재배포금지

































![[포토]](https://www.newsprime.co.kr//data/cache/public/photos/cdn/20251250/art_716010_1765500157_245x140.jpg)




